SGK Hóa Học 8 - Bài 11: Bài luyện tập 2
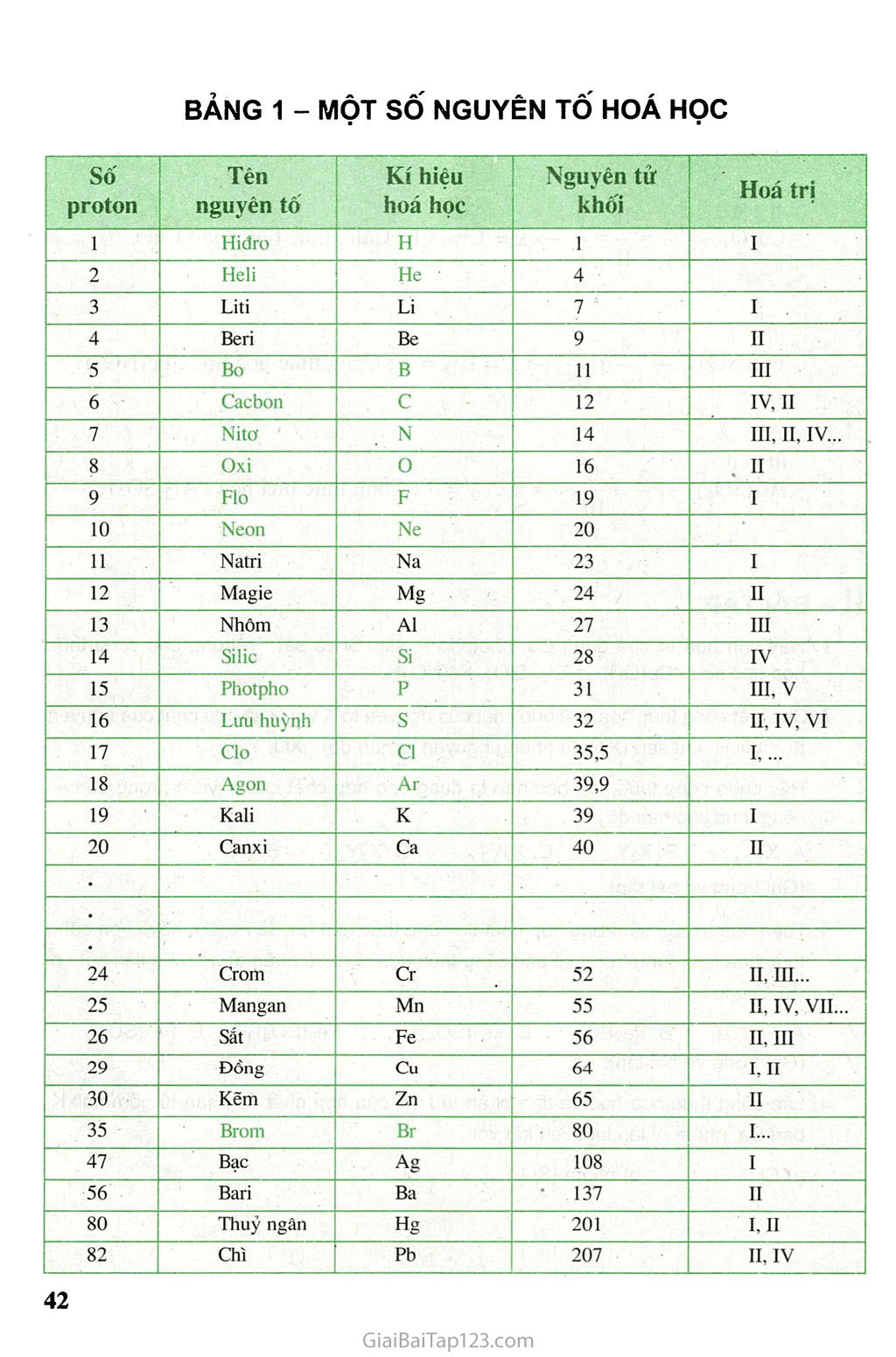
7U1, BẢI LUYỆN TẠP 2 Nắm chắc cách ghi công thức hoá học, khái niệm hoá trị và việc vận dụng quy tắc hoá trị. I - KIẾN THỨC CẦN NHỚ 1 . Chất được biểu diễn bằng công thức hoá học. Đơn chất A (đơn chất kim loại và một vài phi kim như : s, c...). Ax (phần lớn đơn chất phi kim, thường X = 2). Hợp chất AxBy, AxByCz... Mỗi công thức hoá học chỉ một phân tử của chất (trừ đơn chất A) và cho biết ba ý về chất. 2. Hoá trị là con số biểu thị khả năng liên kết của nguyên tử hay nhóm nguyên tử. ạ b Với hợp chất AxBy. Trong đó : A, B có thể là nguyên tử hay nhóm nguyên tử, a, b là hoá trị củạ A, B. Luôn có : XX a = y X b (quy tắc hoá trị). Vận dụng : a) Tính hoá trị chưa biết Thí dụ III b ? A1 F3 -> b = 1 X IIĨ _ạ? II Fe2(Số4)3 —> a - 3 X II b) Lập công thức hoá học Thí dụ n n X II 1 CuxOy —> — = 77 , —> X = 1, y = 1 ; Công thức hoá học : CuO. y II 1 111 1 X ĩ Fex(NO3)y —» — = 77“ —> X = 1, y = 3 ; Công thức hoá học : Fe(NC>3)3. y III 111 11 X II - Alx(SO4)y —» — = 77"—»x = 2, y = 3 ; Công thức hoá học : AbCSCUb- y III II - BÀI TẬP Hãy tính hoá trị của đồng Cu, photpho p, silic Si và sắt Fe trong các công thức hoá học sau : Cu(OH)2, PCI5, S1O2, Fe(NC>3)3. Cho biết công thức hoá học hợp chất của nguyên tố X với o và hợp chất của nguyên tố Y với H như sau (X, Y là những nguyên tố nào đó) : xo, YH3. Hãy chọn công thức hoá học nào là đúng cho hợp chất của X với Y trong số các công thức cho sau đây : A. XY3, B. X3Y, c. X2Y3, D. X3Y2, E. XY (Ghi trong vở bài tập). Theo hoá trị của sắt trong hợp chất có công thức hoá học là Fẽ2O3, hãy chọn công thức hoá học đúng trong số các công thức hợp chất có phân tử gớm Fe liên kết với (SO4) sau : A. FeSO4, B. Fe2SO4, c. Fe2(SO4)2, D. Fe2(SO4)3, E. Fe3(SŨ4)2 (Ghi trong vở bài tập). Lập công thức hoá học và tính phân tử khối của hợp chất có phân tử gồm kali K, bari Ba, nhôm AI lần lượt liên kết với : a) Cl ; b) nhóm (SO4). BẢNG 1 - MỘT SỐ NGUYÊN TÔ HOÁ HỌC Số proton Tén nguyên tô Kí hiệu hoá học Nguyên tử khối Hoá trị 1 Hiđro H 1 I 2 Heli He • 4 3 Liti Li 7 I 4 Beri Be 9 II 5 Bo B 11 III 6 Cacbon c 12 IV, II 7 Nitơ N 14 III, II, IV... 8 Oxi 0 16 II 9 Flo F 19 I 10 Neon Ne 20 11 Natri Na 23 I 12 Magie Mg 24 II 13 Nhôm AI 27 III 14 Silic Si 28 IV 15 Photpho p 31 III, V 16 Lưu huỳnh s 32 II, IV, VI 17 Clo C1 35,5 I,... 18 Agon Ar 39,9 19 Kali K 39 I 20 Canxi Ca 40 II • • • 24 Crom Cr 52 II, III... 25 Mangan Mn 55 II, IV, VII... 26 Sắt Fe 56 II, III 29 Đồng Cu 64 I, II 30 Kẽm Zn 65 II 35 Brom Br 80 I... 47 Bạc Ag 108 I 56 Bari Ba 137 II 80 Thuỷ ngân Hg 201 I, II 82 Chì Pb 207 II, IV (Trong bảng các nguyên tố phi kim in chữ màu xanh, trong số đó có heli, neon, agon là nguyện tố khí hiếm. Các nguyên tố kim loại in chữ màu đen). Chú thích Khi liên kết với nguyên tử H và kim loại, nguyên tố phi kim chỉ thê hiện một hoá trị và là hoá trị ghi ở đầu. Những tên nguyên tố như cacbon, clo... có nguồn gốc từ tên tiếng La-tinh (carboneum, chlorum...). Tên tiếng La-tinh của lưu huỳnh là sulfur... BẢNG 2 - HOÁ TRỊ CỦA MỘT số NHÓM NGUYÊN TỬ Tên nhóm Hoá trị Hiđroxit(*\OH); Nitrat (NO3) I Sunfat (SO4); Cacbonat (CO3) II Photphat (PO4) III